
编者按
骨髓增生异常综合征(Myelodysplastic Syndromes, MDS),是起源于造血干细胞的异质性髓系克隆性疾病,以无效造血和贫血为主要特征,约30%的MDS患者最终会发展为急性髓系白血病(Acute Myeloid Leukemia, AML)。对许多MDS患者而言,反复的贫血和输血是生活中难以摆脱的噩梦。尽管新药Luspatercept的出现为患者带来了曙光,但它是如何起效的、为何只对部分患者有效,一直是个未解之谜。
本期我们分享2025年5月27日发表在Journal of Clinical Investigation(IF=13.6)上的一项最新研究成果,该研究利用斑马鱼、小鼠、人类原代细胞等多模型及基因编辑技术,首次揭示了骨髓增生异常综合征(MDS) 贫血的分子机制,发现GDF11–SMAD2通路通过调控GATA1剪接影响红细胞生成,是MDS贫血的关键机制,并阐明了luspatercept的作用机理,为MDS的精准治疗提供了新的理论基础和潜在生物标志物。
01、研究亮点
首次揭示了GDF11–SMAD2通路通过调控GATA1剪接影响红细胞生成;
人类原代细胞、斑马鱼、小鼠等多模型一致验证了GDF11/luspatercept对GATA1s和贫血的调控作用;
在MDS患者中证实Luspatercept的作用机制,其通过抑制该轴、恢复GATA1正常剪接而发挥作用的分子基础,为生物标志物开发提供依据。
02、主要研究成果
1. MDS样本中GDF11/ACVR2B/SMAD2通路上调
研究人员分析了183例MDS患者的CD34⁺细胞,发现相较于健康对照组,MDS患者的GDF11、ACVR2B、SMAD2的mRNA水平显著升高,而低风险MDS亚型——难治性贫血(RA)和环形铁幼粒细胞性难治性贫血(RARS)患者的GDF11和ACVR2B转录本水平更高,贫血是其主要的临床表现。此外,研究人员观察到,SMAD2表达水平较高的样本,其血红蛋白(Hb)值较低。部分MDS患者外周血浆中检测到GDF11;在GDF11水平升高的患者骨髓样本中可见pSMAD2、ACVR2B表达水平升高。
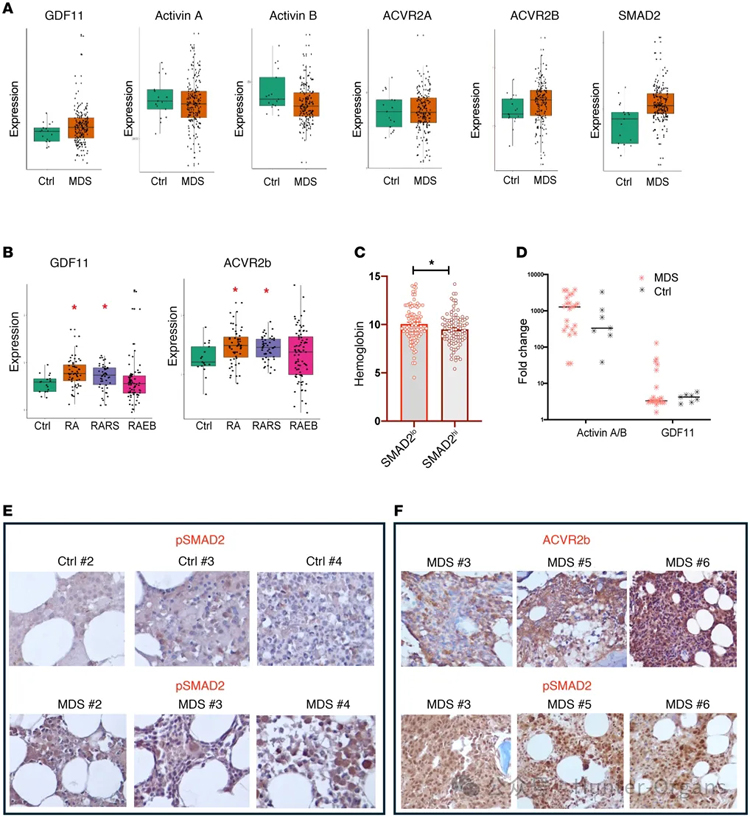
图1
2. GDF11抑制红细胞生成
随后,研究人员发现,在人CD34⁺造血干细胞/祖细胞(HSPCs)和髓系细胞系中,GDF11可磷酸化SMAD2,而新药luspatercept可以阻断这一过程。为了确定GDF11对人类红细胞生成过程的功能影响,实验结果显示,GDF11处理红系祖细胞(BFU-E/CFU-E阶段),会导致后期红细胞成熟(GlyA⁺细胞)减少,且细胞倍增时间缩短,新药Luspatercept可逆转这些效应,这表明GDF11在红系分化的后期阶段具有抑制作用。
接着,研究人员利用斑马鱼测试了GDF11在体内的作用,实验结果显示,斑马鱼胚胎注射GDF11后出现贫血表型,其血红蛋白减少,Luspatercept处理后会使斑马鱼贫血表型缓解,且呈剂量依赖性。
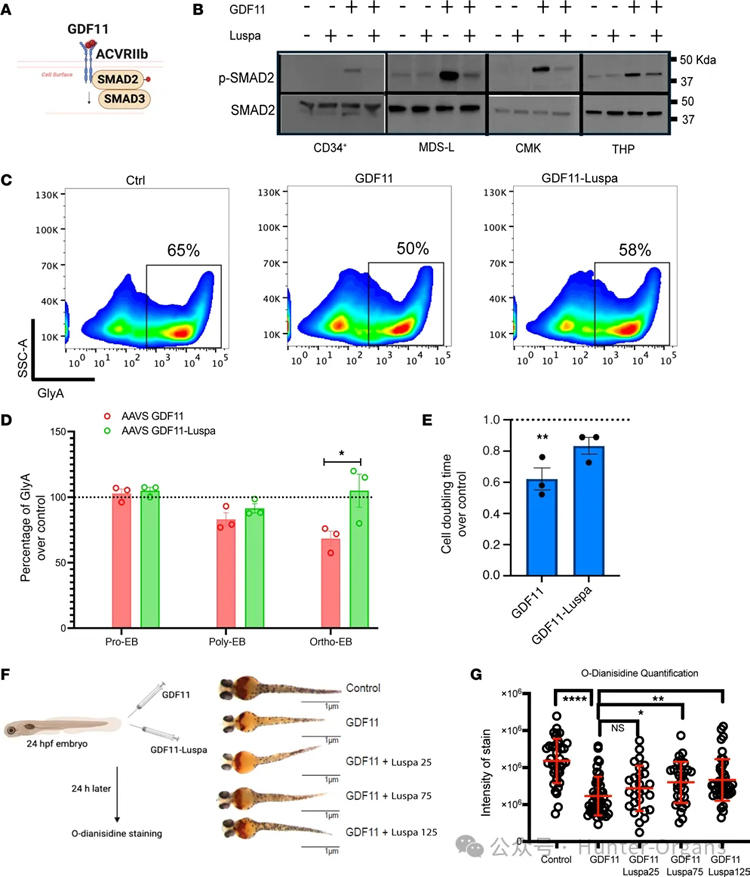
图2
3. GDF11/SMAD2信号通路激活下游转录调控
为了评估pSMAD2在基因组上的结合,并分析GDF11/pSMAD2诱导的转录组变化,研究人员通过处理处于BFU-E/CFU-E成熟阶段的人红系祖细胞,并对相同样本进行了ChIP-Seq和RNA-Seq分析。ChIP-Seq结果显示,GDF11处理导致SMAD2结合位点显著减少;SMAD2富集于与红细胞生成相关的基因位点,如血红蛋白基因、转录因子及GATA1内含子1区域结合。RNA-Seq结果显示,GDF11上调抑制血红蛋白和Myc调控的通路,并降低GATA1的mRNA水平。值得注意的是,GDF11处理导致GATA1外显子2跳跃增加。
接着,研究人员利用基因编辑技术敲除了GATA1内含子1中SMAD2结合位点,阻止了GDF11诱导的外显子2跳跃,发现GDF11处理会诱导GATA1s产生功能受损的短型异构体,Luspatercept可逆转此效应。
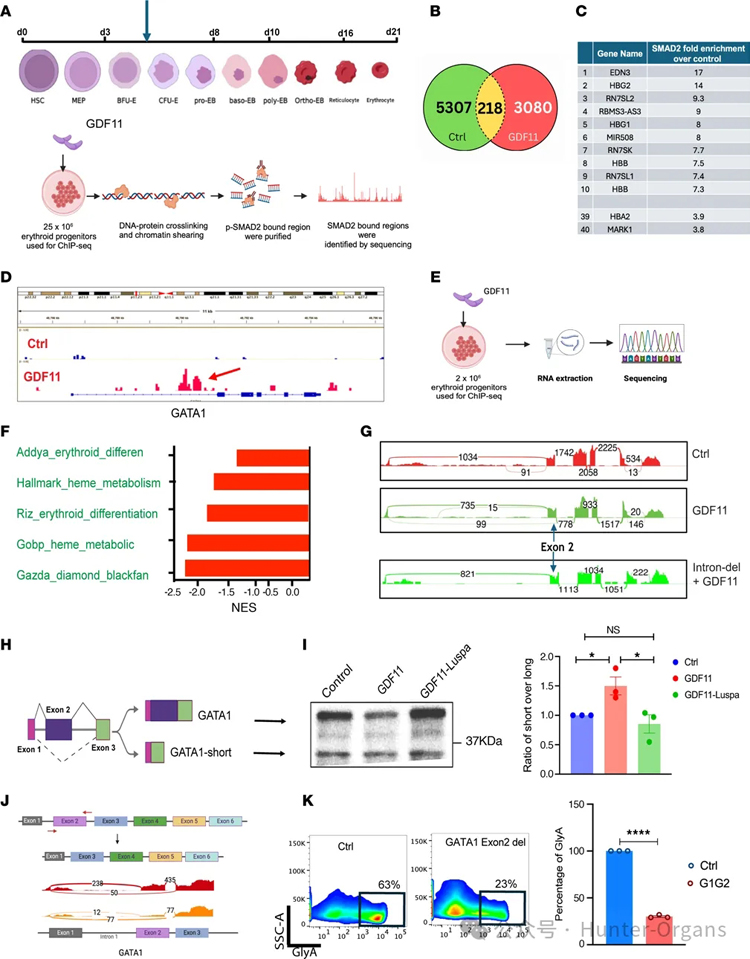
图3
4. Luspatercept可显著改善Gata1s导致的贫血状态
随后,研究人员通过敲除小鼠Gata1基因第2外显子 (Gata1s小鼠),来模拟持续性巨幼红细胞性贫血。在小鼠模型中,Luspatercept (RAP-536) 治疗8周后,显著改善了Gata1s小鼠的贫血状态,红细胞计数(RBC)、血红蛋白(Hb)、红细胞比容(HCT)升高,且RAP-536增加了骨髓红系祖细胞数量和成熟度。这些研究表明,GATA1的过度表达可以改善由于GATA1缺失引起的贫血,因此,研究人员推测RAP-536可能通过增加GATA1表达来克服Gata1s的低活性,从而挽救无效造血。
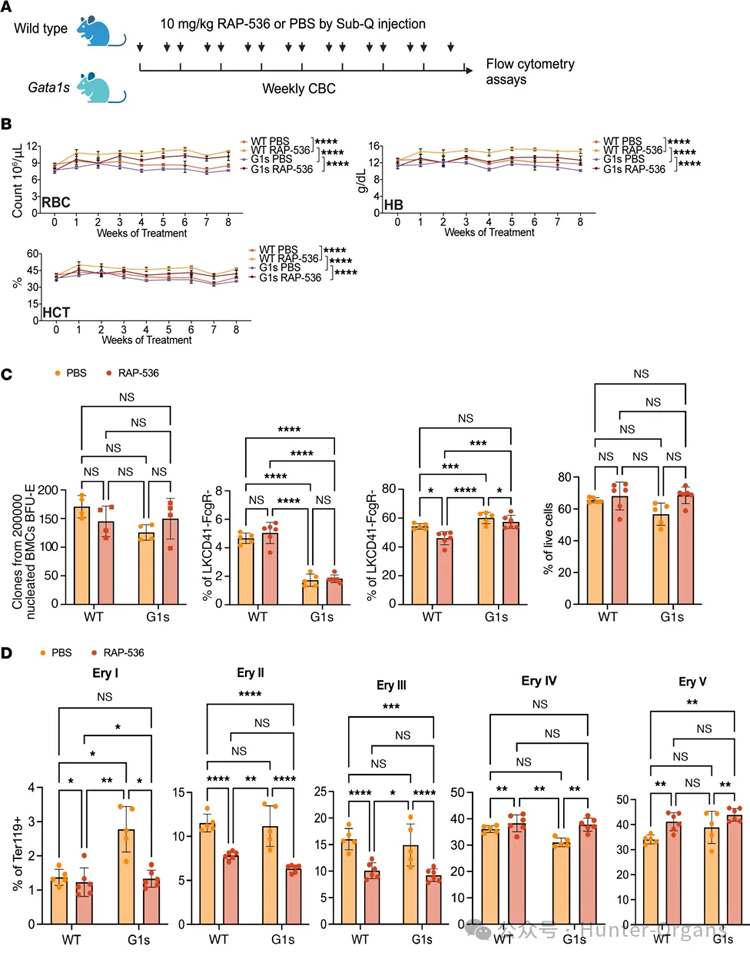
图4
5. 在MDS患者中证实GATA1s比例与luspatercept疗效相关
接着,研究人员在MEDALIST三期临床试验中,以23名参与MEDALIST试验的MDS患者为研究对象,其中9名为非应答者, 14名为应答者,并对治疗前后骨髓样本进行了RNA-Seq分析。结果显示,对luspatercept有反应的患者在治疗前表现出较高的GATA1s比例,治疗后其红细胞计数上升与GATA1s相对减少相关。
基线时,应答者与非应答者整体转录组差异不大,但RNA剪接事件存在显著差异,非应答者更多。基线时,应答者骨髓样本中GATA1外显子2跳跃事件,即GATA1s产生显著高于非应答者。经过治疗24周后,应答者的GATA1外显子2跳跃比率下降,而非应答者无此趋势或反而上升,且两组间GATA1/ GATA1s比值变化存在显著交互作用。
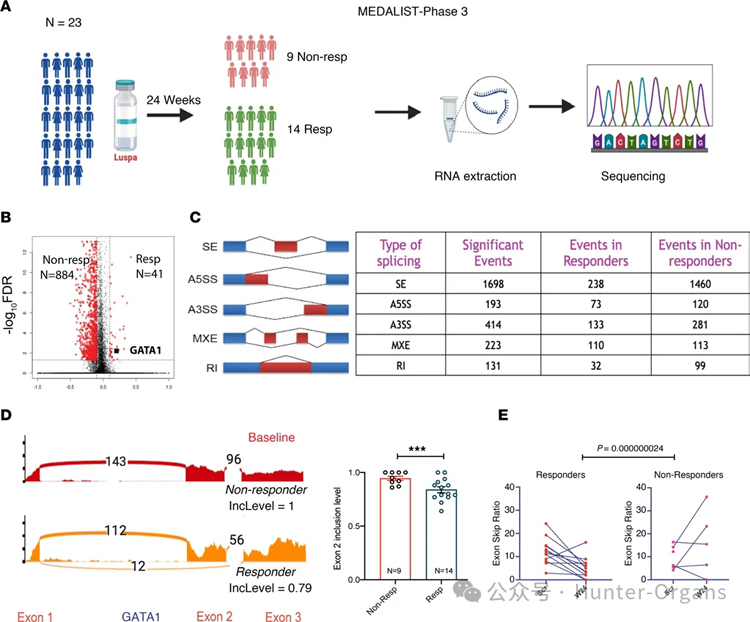
图5
为了更好地助力缺铁性贫血等相关疾病研究,环特生物通过在斑马鱼上对调控DMT1功能的基因进行基因编辑,成功构建了缺铁性贫血模型,来有效模拟人类缺铁性贫血的病理过程,并利用该模型系统评价改善贫血与补血药物/营养保健食品的相关功效,为临床治疗提供参考和科学证据。欢迎新老客户咨询!
03、编者点评
本研究探讨了骨髓增生异常综合征(MDS) 中贫血的分子机制,首次揭示了GDF11–SMAD2通路通过调控GATA1剪接影响红细胞生成,并通过人类原代细胞、斑马鱼、小鼠等多模型验证了GDF11/luspatercept对GATA1s和贫血的调控作用,为生物标志物开发提供了新依据,更为MDS提供了新的治疗策略和理论依据,展现出广阔的应用前景。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、基因编辑、类器官、哺乳动物、人体”等多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,脑类器官、胃癌、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
参考文献:
Aluri, S., et al. (2025). Splicing of erythroid transcription factor is associated with therapeutic response in myelodysplastic syndromes. The Journal of Clinical Investigation, 135(13).
