2023年7月20日,中国药科大学李萍/陈君研究团队在Acta Pharmaceutica Sinica B(IF 14.5)发表题为“A high-throughput Gaussia luciferase reporter assay for screening potential gasdermin E activators against pancreatic cancer”的文章。研究首次报道了用于高通量筛选潜在抗PDAC的GSDME激活剂的hGLuc-hGSDME-PCA系统,揭示该系统在鉴定引发GSDME依赖性焦亡的化合物和开发有前景的PDAC治疗药物方面具有重要意义。

01 研究背景
胰腺导管腺癌(PDAC)是胰腺癌的主要类型,占胰腺癌的95%,预后极差且当前治疗方法疗效有限。研究发现,激活的蛋白酶caspase-3在gasdermin E(GSDME)缺乏的细胞中倾向于诱导细胞凋亡,而在GSDME充足的细胞中倾向于诱导细胞焦亡。据报道GSDME在大多数肿瘤细胞中是沉默的,但其在PDAC细胞中高表达,因而由GSDME介导的细胞焦亡可能是一种潜在的对抗PDAC的创新策略。
· 维真助力 ·
基因信息
gasdermin E(介导细胞焦亡的GSDM蛋白家族成员)
实验动物
PANC-1 GSDME WT细胞异种移植的小鼠模型
病毒产品
AAV-shGSDME、AAV-shC
注射方式
瘤内注射两次,每次间隔三天
病毒用量
5.0x1011vg/mouse
02研究方法与结果
1. hGLuc-hGSDME-PCA筛选系统的构建和条件优化
正常情况下,GSDME蛋白在细胞质中不具有诱导细胞死亡的活性。然而,当特定刺激触发caspase-3时,全长GSDME可以被caspase-3切割成GSDME-N和GSDME-C,随后GSDME-N之间的相互作用促进了焦亡的发生。利用简单灵敏的GLuc报告基因,作者构建了hGLuc-hGSDME-PCA系统,寻找能够特异性激活GSDME并导致焦亡的化合物。将临床治疗胰腺癌的多种化合物或已发表的焦亡诱导剂施用于PANC-1细胞,发现sorafenib表现出极好的焦亡诱导效果,并伴随着细胞膜破裂和caspase-3裂解。随后,作者在转染试剂、DNA转染量、DNA与转染剂的比例、细胞接种密度等方面对hGLuc-hGSDME-PCA筛选系统进行了优化。
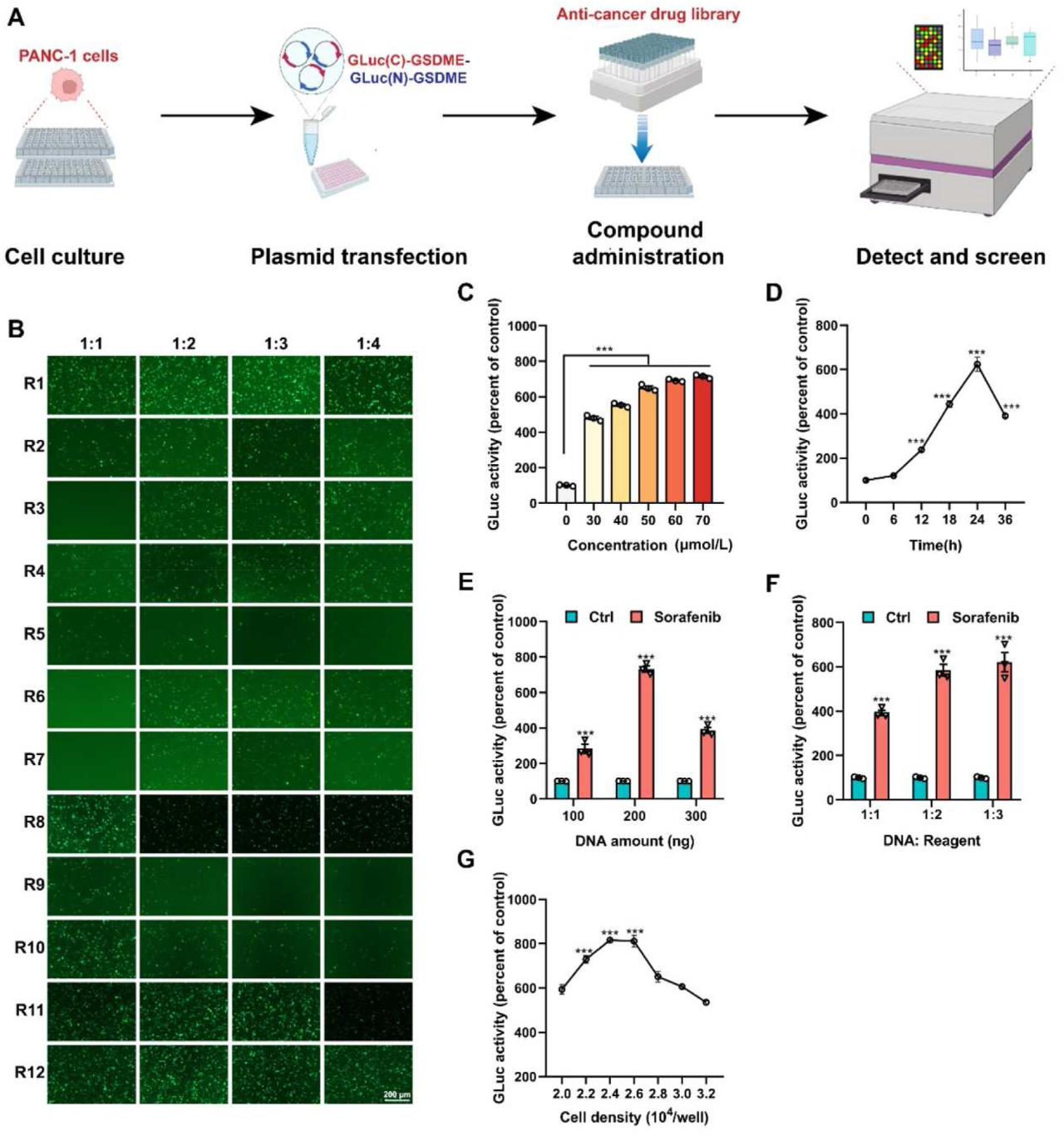
hGLuc-hGSDME-PCA筛选系统的优化
2. Ponatinib和perifosine抑制PDAC细胞的生长
作者利用hGLuc-hGSDME-PCA系统,对FDA批准的抗癌药物文库进行筛选,首次发现化合物ponatinib和perifosine可以诱导GSDME的裂解。进一步的分析数据表明ponatinib和perifosine处理均可显著抑制PDAC细胞系活力,抑制作用具有剂量和时间依赖性。克隆形成实验和EdU插入实验证明ponatinib和perifosine抑制PANC-1细胞增殖并提高LDH释放量。提示ponatinib和perifosine可能是抗PDAC的候选药物。
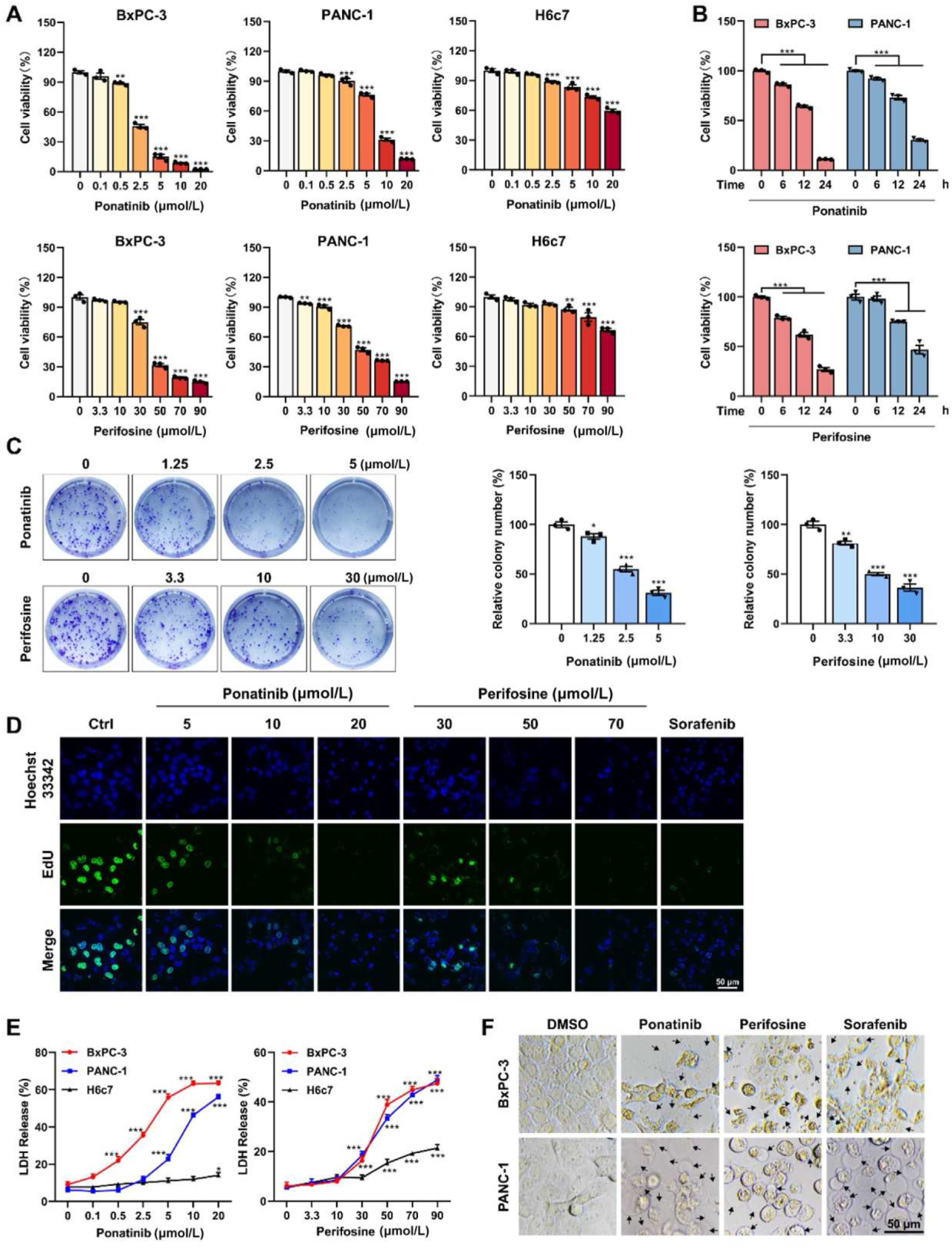
Ponatinib和perifosine抑制PDAC细胞增殖,诱导细胞死亡
3. Ponatinib和perifosine通过caspase-3/GSDME途径触发PDAC细胞焦亡
Ponatinib和perifosine以剂量依赖性的方式诱导PDAC细胞中caspase-3和GSDME的裂解,同时胞内GSDME倾向定位于细胞膜。免疫印迹实验表明,与对照组相比,药物治疗后GSDME二聚体和寡聚体条带明显增加,证实ponatinib和perifosine不仅能诱导细胞内GSDME的裂解,还能诱导GSDME的寡聚化;此外,PANC-1和BxPC-3细胞经ponatinib或perifosine处理后直接进入annexin V和PI双阳性阶段,说明两种化合物诱导的是焦亡而不是凋亡。进一步分析表明ponatinib和perifosine主要通过激活caspase-3/GSDME途径引起PDAC细胞焦亡。
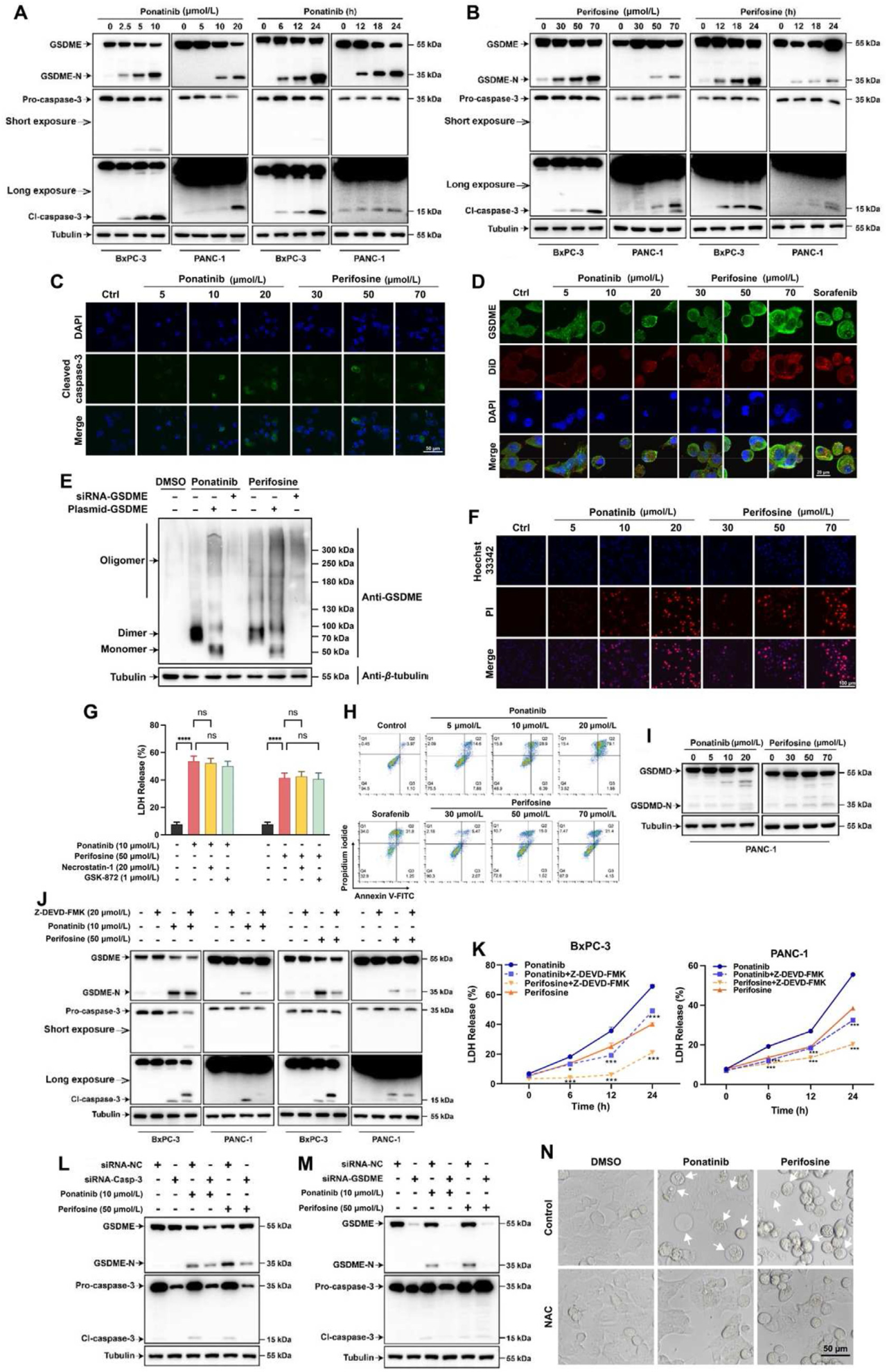
ponatinib和perifosine通过caspase-3/GSDME途径触发PDAC细胞焦亡
4. Perifosine和sorafenib抑制异种移植物肿瘤生长,诱导PDAC细胞焦亡
作者利用PANC-1异种移植肿瘤模型,以验证perifosine在体内的抗PDAC活性,结果表明perifosine以剂量依赖的方式减轻了PANC-1肿瘤负荷,并上调了caspase-3和GSDME的表达,免疫荧光图像也证实perifosine提高了肿瘤组织细胞中cleaved caspase-3的蛋白水平。重要的是,作者首次发现sorafenib也通过焦亡对胰腺癌产生类似的抑制作用,表明perifosine和sorafenib可能通过诱导GSDME介导的焦亡来抑制PDAC肿瘤的体内生长。最后,作者将AAV-shGSDME或AAV-shC注射到PANC-1 GSDME WT细胞形成的皮下肿瘤中,以降低肿瘤组织中GSDME的表达,结果显示瘤内敲低GSDME后,perifosine对PANC-1异种移植肿瘤生长的抑制作用大大减弱。此外,经perifosine处理的AAV-shC组血清LDH水平、GSDME-N和cleaved caspase-3水平均显著升高,并在敲低GSDME后得到逆转。表明GSDME依赖性焦亡在perifosine治疗PDAC中起关键作用。
Perifosine和sorafenib抑制异种移植物肿瘤生长,诱导PDAC细胞焦亡
03 小结
综上所述,hGLuc-hGSDME-PCA系统是一种定量、高通量鉴定化疗药物致细胞焦亡活性的有力工具。基于该系统筛选出的抗癌药物ponatinib和perifosine,通过caspase-3/GSDME途径促进PDAC细胞的焦亡,从而抑制胰腺癌进展。研究结果强调了hGLuc-hGSDME-PCA系统在开发抗PDAC药物中的重要性。
